(주)제이오텍의 'Data Integrity 규제 동향에 대한 안내'에 관한 세미나의 내용은 다음과 같다.
1. 규제 현황
• GMP에서 ‘21 CFR Part 11’인 전자 기록(Electronic Records) 규정은 20년 이상 된 주요 규정으로 현재까지 계속 개정되고 있
는 파트이다.
• Data Integrity(이하 ‘DI’)는 전자 기록 규정을 수립하는 핵심 개념으로 2005년 미국의 ‘Able Labs Scandal’로 인해 의약품 제조
에서 중요한 개념으로 주목받기 시작하였다.
DI 관련 해외 규정
• 우리나라는 식품의약품안전처 주도하에 14년도 PIC/S(의약품 실사상호협력기구)의 42번째 회원국으로 가입되어 글로벌 제약
산업 경쟁력이 강화된 계기를 맞이하게 되었다.
• 식품의약품안전처는 세계 기준에 부합하기 위해 ‘GMP Validation의 특별점검을 일상화한다’는 선언을 바탕으로 현장 감사 주요 사례를 기록하여 배포하였다.
20년도부터 규제 적용을 위한 심사 시범 운영하였으며, 3년의 유예기간을 거친 뒤 23년부터 모든 제조회사의 의약품에 심사
기준을 적용할 예정이다.
DI 관련 주요 지침, 평가 사례 배포 현황
2. ‘DI’ 개념의 핵심 속성
• DI 지침은 데이터 무결성을 위한 개념으로 각 속성의 약어를 결합해 ALCOA Plus로 표현한다. 데이터의 출처 파악과 추적을
위한 9가지 개념은 아래와 같다.
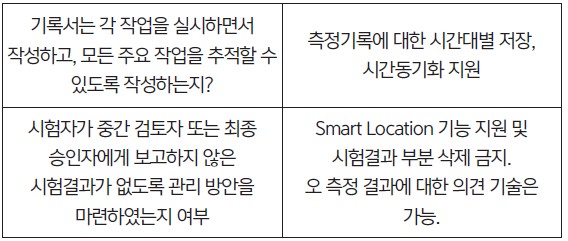
3. 심사 대응을 위한 기술적 제안
• 제약 업계에서 연구, 제조 과정에서 사용하는 장비들의 데이터 무결성을 갖추기 위해 각 평가지침에 아래와 같은 기술적 제안
을 한다.
(주)제이오텍의 'Data Integrity 규제 동향에 대한 안내'에 대한 상세한 내용은 Reference(참고자료)를 통하여 확인할 수 있다.
Reference(참고자료):
- PIC/S Secretariat, PIC/S GUIDANCE ON CLASSIFICATION OF GMP DEFICIENCIES, 2019
- MHRA, Medicines & Healthcare products Regulatory Agency, ‘GXP’ Data Integrity Guidance and Definitions, 2018
- FDA, Data Integrity and Compliance With CGMP Guidance for Industry, 2016
- 식품의약품안전처, 의약품 제조업체 데이터 완전성 (Data Integrity) 평가지침, 2020
- 식품의약품안전처, 바이오의약품 제조업체 데이터 완전성(Data Integrity) 평가지침, 2020
- 식품의약품안전처, 의약품 제조 및 품질관리기준(GMP) 현장감시 주요 지적사례, 2021
<2022 사이언스 KOREA LAB 컨퍼런스 현장 사진>
The Person in Charge(담당자): Ryu Geunjae
Maker(제조사): JEIOTECH
Mail inquiry: gjryu@jeiotech.com
Data Services(자료제공): JEIOTECH
<이 기사는 사이언스21 매거진 2023년 1월호에 게재 되었습니다.>
 DI 관련 해외 규정• 우리나라는 식품의약품안전처 주도하에 14년도 PIC/S(의약품 실사상호협력기구)의 42번째 회원국으로 가입되어 글로벌 제약산업 경쟁력이 강화된 계기를 맞이하게 되었다.• 식품의약품안전처는 세계 기준에 부합하기 위해 ‘GMP Validation의 특별점검을 일상화한다’는 선언을 바탕으로 현장 감사 주요 사례를 기록하여 배포하였다.20년도부터 규제 적용을 위한 심사 시범 운영하였으며, 3년의 유예기간을 거친 뒤 23년부터 모든 제조회사의 의약품에 심사기준을 적용할 예정이다.
DI 관련 해외 규정• 우리나라는 식품의약품안전처 주도하에 14년도 PIC/S(의약품 실사상호협력기구)의 42번째 회원국으로 가입되어 글로벌 제약산업 경쟁력이 강화된 계기를 맞이하게 되었다.• 식품의약품안전처는 세계 기준에 부합하기 위해 ‘GMP Validation의 특별점검을 일상화한다’는 선언을 바탕으로 현장 감사 주요 사례를 기록하여 배포하였다.20년도부터 규제 적용을 위한 심사 시범 운영하였으며, 3년의 유예기간을 거친 뒤 23년부터 모든 제조회사의 의약품에 심사기준을 적용할 예정이다. DI 관련 주요 지침, 평가 사례 배포 현황2. ‘DI’ 개념의 핵심 속성• DI 지침은 데이터 무결성을 위한 개념으로 각 속성의 약어를 결합해 ALCOA Plus로 표현한다. 데이터의 출처 파악과 추적을위한 9가지 개념은 아래와 같다.
DI 관련 주요 지침, 평가 사례 배포 현황2. ‘DI’ 개념의 핵심 속성• DI 지침은 데이터 무결성을 위한 개념으로 각 속성의 약어를 결합해 ALCOA Plus로 표현한다. 데이터의 출처 파악과 추적을위한 9가지 개념은 아래와 같다.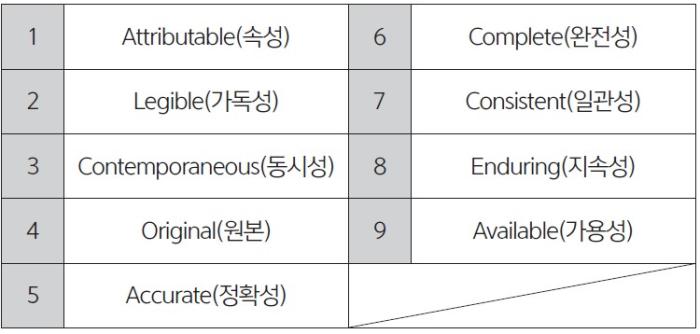 3. 심사 대응을 위한 기술적 제안• 제약 업계에서 연구, 제조 과정에서 사용하는 장비들의 데이터 무결성을 갖추기 위해 각 평가지침에 아래와 같은 기술적 제안을 한다.
3. 심사 대응을 위한 기술적 제안• 제약 업계에서 연구, 제조 과정에서 사용하는 장비들의 데이터 무결성을 갖추기 위해 각 평가지침에 아래와 같은 기술적 제안을 한다.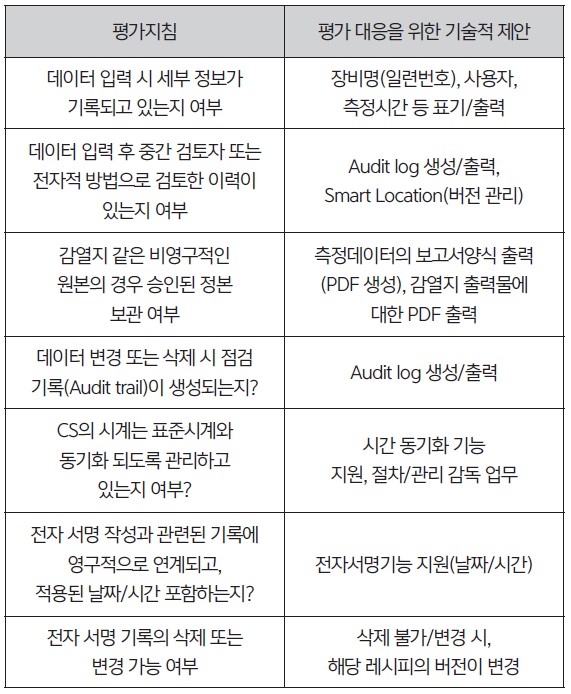
 (주)제이오텍의 'Data Integrity 규제 동향에 대한 안내'에 대한 상세한 내용은 Reference(참고자료)를 통하여 확인할 수 있다.Reference(참고자료):- PIC/S Secretariat, PIC/S GUIDANCE ON CLASSIFICATION OF GMP DEFICIENCIES, 2019- MHRA, Medicines & Healthcare products Regulatory Agency, ‘GXP’ Data Integrity Guidance and Definitions, 2018- FDA, Data Integrity and Compliance With CGMP Guidance for Industry, 2016- 식품의약품안전처, 의약품 제조업체 데이터 완전성 (Data Integrity) 평가지침, 2020- 식품의약품안전처, 바이오의약품 제조업체 데이터 완전성(Data Integrity) 평가지침, 2020- 식품의약품안전처, 의약품 제조 및 품질관리기준(GMP) 현장감시 주요 지적사례, 2021
(주)제이오텍의 'Data Integrity 규제 동향에 대한 안내'에 대한 상세한 내용은 Reference(참고자료)를 통하여 확인할 수 있다.Reference(참고자료):- PIC/S Secretariat, PIC/S GUIDANCE ON CLASSIFICATION OF GMP DEFICIENCIES, 2019- MHRA, Medicines & Healthcare products Regulatory Agency, ‘GXP’ Data Integrity Guidance and Definitions, 2018- FDA, Data Integrity and Compliance With CGMP Guidance for Industry, 2016- 식품의약품안전처, 의약품 제조업체 데이터 완전성 (Data Integrity) 평가지침, 2020- 식품의약품안전처, 바이오의약품 제조업체 데이터 완전성(Data Integrity) 평가지침, 2020- 식품의약품안전처, 의약품 제조 및 품질관리기준(GMP) 현장감시 주요 지적사례, 2021
 <2022 사이언스 KOREA LAB 컨퍼런스 현장 사진>The Person in Charge(담당자): Ryu GeunjaeMaker(제조사): JEIOTECHMail inquiry: gjryu@jeiotech.comData Services(자료제공): JEIOTECH<이 기사는 사이언스21 매거진 2023년 1월호에 게재 되었습니다.>글쓴날 : [23-01-10 15:49]
<2022 사이언스 KOREA LAB 컨퍼런스 현장 사진>The Person in Charge(담당자): Ryu GeunjaeMaker(제조사): JEIOTECHMail inquiry: gjryu@jeiotech.comData Services(자료제공): JEIOTECH<이 기사는 사이언스21 매거진 2023년 1월호에 게재 되었습니다.>글쓴날 : [23-01-10 15:49]