소뇌 발달이상과 조현병의 연관성에 초점
안 교수 연구팀은 뇌질환에서 중요한 신경세포의 사멸, 시냅스 형성 조절의 근본적 기작과 원리를 규명하는 것을 목표로 연구를 진행하고 있다. 뇌신경세포의 비정상적 사멸, 이주 실패, 시냅스 형성 실패로 인한 신경망회로 손상 등은 신경정신질환, 발달성 뇌질환과 같은 다양한 뇌질환의 원인이 된다.
신경세포의 가소성이라는 특성을 고려하면 발달 과정 중에 있는 영아나 소아의 뇌세포 손상은 손상되지 않은 뇌세포들에 의해 기능 대체가 일어날 수 있어 신경정신질환, 발달성 뇌질환의 조기진단과 치료는 매우 중요하다.
20,000여 개의 인간 유전자 중 80% 이상의 유전자가 뇌발생 과정 중 발현되고, 이들의 후성유전학적 변이가 신경질환의 원인으로 주목받고 있다. 하지만 현재까지 어떤 유전자가 어떤 뇌발생, 기능에 기여하는지 그리고 이들의 발현이 후성유전학적 변화로 인해 어떻게 잘못 조절되는지에 대한 연구와 이해는 아직 매우 부족하다.
특히 과거 정신분열병으로 불린 조현병(Schizophrenia; SZ)은 망상, 환각, 와해된 언어나 행동, 사고장애의 증상이 나타나는 비정상적인 사고와 현실에 대한 인지 및 검증력 이상을 특징으로 하는 정신질환이다. 인구의 1%가 조현병을 앓고 있을 정도로 유병률이 높고, 매년 그 수는 급증하는 추세다.
그러나 발병의 원인에 대해서는 명확히 알려져 있지 않다. 지금까지 조현병은 대뇌에서 주로 연구가 이루어져 왔으나 한편으로는, 조현병 환자 MRI 분석 결과 소뇌가 위축되어 있고, 퍼킨지 세포의 수가 감소되어 있다는 보고가 지속되어 왔다.
이후 소뇌 기능이상과 발달성 정신질환과의 연관성이 꾸준히 제기되었지만, 그 병인과 치료법에 대해서는 연구가 미미한 상황이다.
“사실 그동안 뇌연구에서 상대적으로 소뇌영역의 연구는 다소 미진했습니다. 하지만 최근 소뇌가 ‘운동 명령(Motor command)’의 조절·수행뿐만 아니라 기억·학습, 사회성, 인지기능 등 뇌의 고위기능 조절에도 관여한다는 증거들이 나오고 있습니다.
또한 최근 10여 년 동안의 연구들은 신경정신질환(조현병, 자폐증, 주의력결핍과잉행동증후군 등) 환자들이 공통적으로 소뇌발달이상과 소뇌의 주요 신경세포인 퍼킨지 세포의 비정상적 감소, 발달이상을 지속적으로 보고하고 있습니다.”
연구팀은 세포의 죽음을 방어하고 증식을 촉진하는 유전자로 알려져 있는 Ebp1(ErbB3 binding protein 1)이 신경세포분화, 축삭형성, 기능시냅스 발생에 중요함을 보고해 왔다.
최근에는 Ebp1 유전자 결손마우스 연구를 통해 Ebp1은 뇌발달 초기단계에서 후성유전조절인자인 히스톤 메틸화효소(Suv38H1)와 DNA메틸화 효소(DNMT1)의 전사/기능 조절을 통해 뇌발달에 필요한 유전자의 발현을 촉진하고 불필요한 유전자의 발현을 억제해 정상적인 뇌발달이 진행되게 한다는 사실을 규명한 바 있다.
그리고 이 과정에서 Ebp1 유전자를 뇌세포 특이적으로 제거하면 뇌의 여러 영역 중 소뇌형성부전, 소뇌위축(소뇌 크기가 20% 정도 감소)이 생긴다는 사실에 주목했다.
뿐만 아니라 조현병 환자의 뇌조직에서 Ebp1 기능상실 돌연변이가 발견됨에 따라 Ebp1 유전자 결핍이나 기능이상으로 인한 소뇌위축이 조현병의 새로운 원인 기전일 것이라는 가설을 세우고 연구에 돌입했다.
조현병의 새로운 유전적 요인 발견
연구팀은 조현병 환자의 사후뇌조직 엑솜 시퀀싱(SCHEMA:Schizophrenia exome meta-analysis condortium)으로부터 Ebp1 돌연변이가 발견됨에 따라 Ebp1 뇌 특이적 결손마우스를 제작했다.
여러 가지 동물행동실험을 통해 Ebp1 뇌 특이적 결손마우스는 소뇌형성부전에 따른 운동성 저하가 나타나는 것을 확인했다.
조현병 증상을 확인하기 위해 주로 사용하는 선행자극 억제 실험에서는 야생형에 비해 그 수치가 87% 감소한 상태로 조현병 유사 행동을 보였다.
또한 Ebp1 결핍에 따른 소뇌위축의 기작을 찾기 위해 RNA-seq, ChIP-seq을 수행한 결과 Ebp1이 FBXW7(E3 연결 효소, E3 ligase) 히스톤 아세틸화(Histone acetylation)를 억제함으로써 퍼킨지 세포 발달에 중요한 전사인자인 PTF1A 단백질의 안정성을 향상시키는 것으로 나타났다.
이에 소뇌발달의 복구 및 조현병 증상의 완화를 확인하기 위해 임신한 Ebp1 결손마우스의 배아 소뇌에 자궁 내 전기천공법을 이용해 Ebp1 야생형과 돌연변이형을 각각 다시 발현시킨 후 태어나게 했다.
이후 소뇌발달과 조현병 증상을 확인했는데, Ebp1 야생형이 주입된 마우스는 정상적인 소뇌발달이 이뤄지고 조현병 증상이 완화된 반면, 돌연변이를 주입한 마우스는 여전히 발달이상이 생기고 조현병 증상이 전혀 호전되지 않았다. 이는 Ebp1의 돌연변이가 조현병 및 소뇌의 기능 장애에 중요한 연관이 있다는 사실을 규명한 것이라고 할 수 있다.
따라서 이번 연구는 유전적 소인이 주된 발병 원인인 조현병에서 Ebp1이라는 새로운 유전적 요인을 발견하고, 대뇌 중심의 연구에서 벗어나 소뇌기능과 발달성 정신질환의 상관성을 제시했다는 점에서 의미가 크다.
“소뇌발생부전의 원인 기전으로 작용하는 후성유전학적 변이와 이를 제어하는 분자적 기전을 규명함으로써 향후 분자수준에서 소뇌발생 제어 및 소뇌손상 극복 기술 개발을 가능하게 하는 중개 융합연구로 발전하길 기대합니다. 무엇보다 이번 연구는 조현병 환자 맞춤형 치료의 토대를 마련한 연구라고 자부합니다.
즉, 운동성 저하를 보이는 조현병 환자를 대상으로 MRI를 시행해 소뇌위축을 확인하고 유전자 검사로 Ebp1 돌연변이를 확인해 유전자편집기술로 교정하는 등의 치료전략을 세울 수 있는 것이죠. 향후 실용화 및 치료제 적용을 위해서는 실제 임상적 치료 전략을 개선할 수 있는지에 대한 후속연구 진행이 필요합니다.”
이번 연구성과는 국제학술지 ‘분자정신의학 (Molecular Psychiatry)’ 2022년 2월 15일 자 온라인 게재 및 표지에 선정되었다. 현재 관련 내용으로 특허가 진행 중에 있으며, 조현병 치료제 개발의 중요한 단초가 될 것으로 기대된다.
뇌질환의 근원에 다가서다 ‘신경생화학연구실’
안 교수가 이끄는 ‘신경생화학연구실’에서 수행 중인 연구는 크게 세 분야 정도로 나뉜다. 첫 번째로는 신경세포가 ‘어떻게’, ‘왜’ 죽는가이다.
“신경세포의 사멸은 배아 발생 동안 뇌가 정상적인 형태를 갖추기 위해 비정상적이거나 불필요한 세포를 Apoptosis라는 자멸사 과정를 통해 제거하는 중요한 일입니다.
하지만 발생이 다 끝난 후, 성체의 뇌에서 신경세포의 죽음은 사실 ‘재앙’이라고 할 수 있죠. 따라서 이 과정의 실패, 즉 신경세포의 비정상적 사멸은 여러 퇴행성 신경질환의 병인이기도 합니다. 저희는 이런 신경세포의 사멸과 생존에 있어 중요한 단백질들을 발굴하고 그 기전을 연구하고 있습니다.”
두 번째로는 퇴행성 신경질환과 외상성 손상 같은 여러 요인에 의해 생기는 중추신경계 축삭 손상에 대한 연구를 수행하고 있다. 중추신경계 뉴런 축삭 손상은 아주 제한적이고, 거의 재생이 불가능하다고 알려져 있다. 중추신경계의 척박한 환경이 가장 큰 이유로 지목되었지만, 신경세포 외부의 억제신호들을 제어해도 여전히 신경재생이 기대만큼 되지 않는다는 사실이 보고되면서 과학자들은 성체신경세포의 매우 낮은 재생능력을 또 다른 큰 이유로 보고 있다.
연구실에서는 중추신경계 축삭 손상 후 일어나는 변화와 재생이 어려운 원인을 분자적으로 이해하고 손상된 신경의 재생을 촉진하는 방법을 찾고 있다.
세 번째는 신경발달장애와 퇴행성 뇌질환의 원인 및 기전 연구로, 최근 연구실에서 가장 집중하는 분야다.
정상적인 신경발달 조절 기전을 이해하고 그 과정에서 일어나는 전사 조절, 후성유전학적 조절, 유비퀴틴 매개 단백질 분해 기전과 같은 단백질 번역 후 수식 기전의 조절 등이 신경발생 동안 비정상적으로 작동하면 이번 연구처럼 조현병 등 신경정신질환의 원인이 될 수도 있다.
또한 노화 과정 동안 일어나게 되는 이러한 기작들의 오작동이 결국 뉴런의 죽음과 그로 인한 시냅스 붕괴를 일으키고, 이것이 알츠하이머성 치매와 같은 퇴행성 뇌질환의 원인이 되기도 한다. 따라서 연구실에서는 이러한 전사·후성유전학적 조절과 단백질 번역 후 수식 기전의 오류를 찾아 교정하는 방안을 모색하고 있다.
“연구실이 의과대학에 소속되어 있어 여러 장점이 있습니다. 물론 우수한 연구시설과 장비를 보유하고 있다는 물리적인 장점도 있지만, 특히 인간의 질병에 대한 연구를 하는 데에 있어 임상적 의의와 적용 방안을 항상 생각하게 하고 조언을 아끼지 않는 동료교수님들이 계신다는 점입니다.
그리고 해당 질병의 환자를 직접 보고, 연구를 하는 임상연구자분들과 협동연구를 비교적 쉽게 진행할 수도 있죠. 또 다른 측면에서 의과대학 대학원이다 보니 학부나 전공이 다른 다양한 배경의 대학원생들이 같이 모여 연구를 수행하기 때문에 비교적 수평적인 의사소통이 가능하다는 점도 강점이라고 할 수 있습니다.”
도전은 모든 위대한 일의 시작이다
어려움을 이겨내고 얻어낸 성과는 더욱 값지고 소중하다. 그렇기에 연구자들의 연구가 성공을 거두고 그 결과가 세상에 빛을 보게 되는 것은 매우 값진 일이다. 그 한 번의 성공 이면에는 우리가 보지 못했던 아흔아홉 번의 실패가 있었기 때문이다.
하지만 그 아흔아홉 번의 실패를 견뎌내는 동안 숱한 좌절과 난관을 마주해야 한다. 안 교수가 추진해 온 연구들이 성공의 결실을 맺을 수 있었던 것은 팀원들이 실패에 굴복하지 않고, 흔들림 없이 앞으로 나아갈 수 있도록 때로는 냉철하게, 때로는 따뜻하게 동기를 심어 주었기에 가능한 일이었다.
“연구자의 길을 선택한 것은 오롯이 본인의 몫이었고, 진학을 한 것 자체가 평범한 일은 아닐 것입니다.
연구자의 길에 들어선 것은 하루에도 열두 번씩 밀려오는 좌절감과 난관을 내 몫으로 받아들여 겪어내고, 알고 있는 바탕 위에 조금이라도 더 보탤 무언가를 찾아가겠다는 의지를 세상에 공표한 것이죠. 선택을 하기 전에 내가 어떤 사람인지, 내가 무엇을 하고자 하는지, 내가 원하는 것이 무엇이지 잘 생각 보고, 일단 선택을 했다면 철저하게 그 선택을 존중하고 순응해야 한다는 생각입니다.”
아울러 안 교수는 연구현장에 있다 보면 결과를 쉽게 내려고만 하거나 도전할 수 없는 일이라 지레짐작해 중도에 포기하는 학생들이 많다며, 당장은 힘이 들더라도 원하던 연구를 해보고, 시작했다면 최선을 다했으면 하는 바람을 전했다.
“가장 안타까운 건 큰 산을 하나 넘어보면 그다음에는 다른 산들이 별것 아닌 것처럼 보이기도 하고 더 높은 산 앞에서도 움츠러들지 않을 텐데 산이 크다고 항상 산 밑에서 왔다 갔다 하거나 조금 오르다 마는 친구들을 볼 때입니다. 때로는 무식하게 도전해 보는 것도 필요하다고 생각해요. 쓰러지지 않을 만큼만 하고 멈추는 게 아니라 쓰러질 때까지 한번 몰두해 보면 문득 일이 쌓이고 산 하나를 넘었음을 깨닫게 되죠. 그렇게 산을 한번 넘어보면 보이는 게 달라집니다.
경제 법칙은 최소한의 노력으로 최대한의 이윤을 추구하는 게 맞겠지만, 생명과학을 연구하는 과학자로, 연구자로 살기 위해서는 최대한의 노력을 해서 최대 그 너머의 무엇을 추구하라고 감히 말하고 싶습니다.”
안 교수는 또 한 가지 바람으로 연구비 중단이나 수주에 대한 걱정 없이 안정적이고 계획적으로, 심도 있게 연구에 몰두하고 싶다고 덧붙였다. 대부분의 기초연구를 수행하는 연구실들은 업-다운 사이클을 반복하게 되는데, 이러한 기복 없이 장기적인 관점에서 깊이 있게 연구를 이끌어 갈 수 있는 환경이 갖춰졌으면 한다는 것이다.
아울러 연구 결과를 실제 임상에 적용 가능한 수준으로 끌어올려 의·과학과 산업계, 그리고 인류에 직접 기여할 수 있기를 희망한다고 전했다.
거듭되는 도전을 거치며 어느덧 의·과학계의 새로운 길을 여는 주역으로 자리매김 한 안 교수. 매번 상식을 뛰어넘어 온 그를 보며 문득 ‘도전은 모든 위대한 일의 시작이다.’라는 구절이 떠올랐다. 안 교수의 새로운 도전이 질환으로 고통 받고 있는 이들의 ‘위대한 희망’이 되기를 마음 깊이 기대해본다.
취재기자 / 안유정(reporter1@s21.co.kr)
<이 기사는 사이언스21 매거진 2022년 6월호에 게재 되었습니다.>
|
 조현병은 망상, 환청, 정서적 둔감 등의 증상과 더불어 사회적 기능에 장애를 일으킬 수도 있는 정신적 질환을 말한다. 전 세계 인구의 1% 정도가 앓고 있을 만큼 유병률이 높지만, 아직까지 명확한 발병 원인은 밝혀지지 않았다.그동안은 조현병의 원인을 대뇌에서 찾고자 하는 연구들이 주를 이뤄 왔다. 하지만 성균관대 의과대학 의학과 안지인 교수 연구팀은 대뇌 중심의 연구에서 탈피, ‘소뇌’에 중점을 두고 종전과는 전혀 다른 새로운 관점에서 접근했다.그 결과 최근 Ebp1의 돌연변이가 조현병 및 소뇌의 기능 장애에 중요한 연관이 있다는 사실을 규명함으로써 운동성 저하 및 소뇌 크기 감소를 보이는 조현병 환자의 새로운 유전적 원인을 찾아냈다. 정신성 질병 환자 맞춤형 치료의 길을 열며, 국내 연구진의 저력을 보여준 안 교수를 만났다.
조현병은 망상, 환청, 정서적 둔감 등의 증상과 더불어 사회적 기능에 장애를 일으킬 수도 있는 정신적 질환을 말한다. 전 세계 인구의 1% 정도가 앓고 있을 만큼 유병률이 높지만, 아직까지 명확한 발병 원인은 밝혀지지 않았다.그동안은 조현병의 원인을 대뇌에서 찾고자 하는 연구들이 주를 이뤄 왔다. 하지만 성균관대 의과대학 의학과 안지인 교수 연구팀은 대뇌 중심의 연구에서 탈피, ‘소뇌’에 중점을 두고 종전과는 전혀 다른 새로운 관점에서 접근했다.그 결과 최근 Ebp1의 돌연변이가 조현병 및 소뇌의 기능 장애에 중요한 연관이 있다는 사실을 규명함으로써 운동성 저하 및 소뇌 크기 감소를 보이는 조현병 환자의 새로운 유전적 원인을 찾아냈다. 정신성 질병 환자 맞춤형 치료의 길을 열며, 국내 연구진의 저력을 보여준 안 교수를 만났다. 소뇌 발달이상과 조현병의 연관성에 초점안 교수 연구팀은 뇌질환에서 중요한 신경세포의 사멸, 시냅스 형성 조절의 근본적 기작과 원리를 규명하는 것을 목표로 연구를 진행하고 있다. 뇌신경세포의 비정상적 사멸, 이주 실패, 시냅스 형성 실패로 인한 신경망회로 손상 등은 신경정신질환, 발달성 뇌질환과 같은 다양한 뇌질환의 원인이 된다.신경세포의 가소성이라는 특성을 고려하면 발달 과정 중에 있는 영아나 소아의 뇌세포 손상은 손상되지 않은 뇌세포들에 의해 기능 대체가 일어날 수 있어 신경정신질환, 발달성 뇌질환의 조기진단과 치료는 매우 중요하다.20,000여 개의 인간 유전자 중 80% 이상의 유전자가 뇌발생 과정 중 발현되고, 이들의 후성유전학적 변이가 신경질환의 원인으로 주목받고 있다. 하지만 현재까지 어떤 유전자가 어떤 뇌발생, 기능에 기여하는지 그리고 이들의 발현이 후성유전학적 변화로 인해 어떻게 잘못 조절되는지에 대한 연구와 이해는 아직 매우 부족하다.특히 과거 정신분열병으로 불린 조현병(Schizophrenia; SZ)은 망상, 환각, 와해된 언어나 행동, 사고장애의 증상이 나타나는 비정상적인 사고와 현실에 대한 인지 및 검증력 이상을 특징으로 하는 정신질환이다. 인구의 1%가 조현병을 앓고 있을 정도로 유병률이 높고, 매년 그 수는 급증하는 추세다.그러나 발병의 원인에 대해서는 명확히 알려져 있지 않다. 지금까지 조현병은 대뇌에서 주로 연구가 이루어져 왔으나 한편으로는, 조현병 환자 MRI 분석 결과 소뇌가 위축되어 있고, 퍼킨지 세포의 수가 감소되어 있다는 보고가 지속되어 왔다.이후 소뇌 기능이상과 발달성 정신질환과의 연관성이 꾸준히 제기되었지만, 그 병인과 치료법에 대해서는 연구가 미미한 상황이다.“사실 그동안 뇌연구에서 상대적으로 소뇌영역의 연구는 다소 미진했습니다. 하지만 최근 소뇌가 ‘운동 명령(Motor command)’의 조절·수행뿐만 아니라 기억·학습, 사회성, 인지기능 등 뇌의 고위기능 조절에도 관여한다는 증거들이 나오고 있습니다.또한 최근 10여 년 동안의 연구들은 신경정신질환(조현병, 자폐증, 주의력결핍과잉행동증후군 등) 환자들이 공통적으로 소뇌발달이상과 소뇌의 주요 신경세포인 퍼킨지 세포의 비정상적 감소, 발달이상을 지속적으로 보고하고 있습니다.”연구팀은 세포의 죽음을 방어하고 증식을 촉진하는 유전자로 알려져 있는 Ebp1(ErbB3 binding protein 1)이 신경세포분화, 축삭형성, 기능시냅스 발생에 중요함을 보고해 왔다.최근에는 Ebp1 유전자 결손마우스 연구를 통해 Ebp1은 뇌발달 초기단계에서 후성유전조절인자인 히스톤 메틸화효소(Suv38H1)와 DNA메틸화 효소(DNMT1)의 전사/기능 조절을 통해 뇌발달에 필요한 유전자의 발현을 촉진하고 불필요한 유전자의 발현을 억제해 정상적인 뇌발달이 진행되게 한다는 사실을 규명한 바 있다.그리고 이 과정에서 Ebp1 유전자를 뇌세포 특이적으로 제거하면 뇌의 여러 영역 중 소뇌형성부전, 소뇌위축(소뇌 크기가 20% 정도 감소)이 생긴다는 사실에 주목했다.뿐만 아니라 조현병 환자의 뇌조직에서 Ebp1 기능상실 돌연변이가 발견됨에 따라 Ebp1 유전자 결핍이나 기능이상으로 인한 소뇌위축이 조현병의 새로운 원인 기전일 것이라는 가설을 세우고 연구에 돌입했다.
소뇌 발달이상과 조현병의 연관성에 초점안 교수 연구팀은 뇌질환에서 중요한 신경세포의 사멸, 시냅스 형성 조절의 근본적 기작과 원리를 규명하는 것을 목표로 연구를 진행하고 있다. 뇌신경세포의 비정상적 사멸, 이주 실패, 시냅스 형성 실패로 인한 신경망회로 손상 등은 신경정신질환, 발달성 뇌질환과 같은 다양한 뇌질환의 원인이 된다.신경세포의 가소성이라는 특성을 고려하면 발달 과정 중에 있는 영아나 소아의 뇌세포 손상은 손상되지 않은 뇌세포들에 의해 기능 대체가 일어날 수 있어 신경정신질환, 발달성 뇌질환의 조기진단과 치료는 매우 중요하다.20,000여 개의 인간 유전자 중 80% 이상의 유전자가 뇌발생 과정 중 발현되고, 이들의 후성유전학적 변이가 신경질환의 원인으로 주목받고 있다. 하지만 현재까지 어떤 유전자가 어떤 뇌발생, 기능에 기여하는지 그리고 이들의 발현이 후성유전학적 변화로 인해 어떻게 잘못 조절되는지에 대한 연구와 이해는 아직 매우 부족하다.특히 과거 정신분열병으로 불린 조현병(Schizophrenia; SZ)은 망상, 환각, 와해된 언어나 행동, 사고장애의 증상이 나타나는 비정상적인 사고와 현실에 대한 인지 및 검증력 이상을 특징으로 하는 정신질환이다. 인구의 1%가 조현병을 앓고 있을 정도로 유병률이 높고, 매년 그 수는 급증하는 추세다.그러나 발병의 원인에 대해서는 명확히 알려져 있지 않다. 지금까지 조현병은 대뇌에서 주로 연구가 이루어져 왔으나 한편으로는, 조현병 환자 MRI 분석 결과 소뇌가 위축되어 있고, 퍼킨지 세포의 수가 감소되어 있다는 보고가 지속되어 왔다.이후 소뇌 기능이상과 발달성 정신질환과의 연관성이 꾸준히 제기되었지만, 그 병인과 치료법에 대해서는 연구가 미미한 상황이다.“사실 그동안 뇌연구에서 상대적으로 소뇌영역의 연구는 다소 미진했습니다. 하지만 최근 소뇌가 ‘운동 명령(Motor command)’의 조절·수행뿐만 아니라 기억·학습, 사회성, 인지기능 등 뇌의 고위기능 조절에도 관여한다는 증거들이 나오고 있습니다.또한 최근 10여 년 동안의 연구들은 신경정신질환(조현병, 자폐증, 주의력결핍과잉행동증후군 등) 환자들이 공통적으로 소뇌발달이상과 소뇌의 주요 신경세포인 퍼킨지 세포의 비정상적 감소, 발달이상을 지속적으로 보고하고 있습니다.”연구팀은 세포의 죽음을 방어하고 증식을 촉진하는 유전자로 알려져 있는 Ebp1(ErbB3 binding protein 1)이 신경세포분화, 축삭형성, 기능시냅스 발생에 중요함을 보고해 왔다.최근에는 Ebp1 유전자 결손마우스 연구를 통해 Ebp1은 뇌발달 초기단계에서 후성유전조절인자인 히스톤 메틸화효소(Suv38H1)와 DNA메틸화 효소(DNMT1)의 전사/기능 조절을 통해 뇌발달에 필요한 유전자의 발현을 촉진하고 불필요한 유전자의 발현을 억제해 정상적인 뇌발달이 진행되게 한다는 사실을 규명한 바 있다.그리고 이 과정에서 Ebp1 유전자를 뇌세포 특이적으로 제거하면 뇌의 여러 영역 중 소뇌형성부전, 소뇌위축(소뇌 크기가 20% 정도 감소)이 생긴다는 사실에 주목했다.뿐만 아니라 조현병 환자의 뇌조직에서 Ebp1 기능상실 돌연변이가 발견됨에 따라 Ebp1 유전자 결핍이나 기능이상으로 인한 소뇌위축이 조현병의 새로운 원인 기전일 것이라는 가설을 세우고 연구에 돌입했다.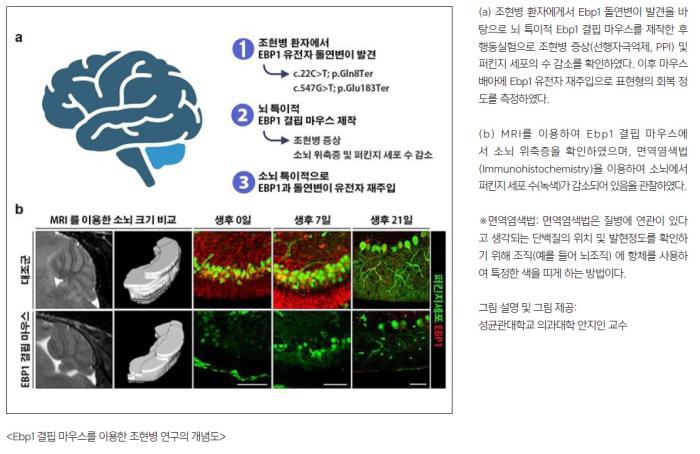 조현병의 새로운 유전적 요인 발견연구팀은 조현병 환자의 사후뇌조직 엑솜 시퀀싱(SCHEMA:Schizophrenia exome meta-analysis condortium)으로부터 Ebp1 돌연변이가 발견됨에 따라 Ebp1 뇌 특이적 결손마우스를 제작했다.여러 가지 동물행동실험을 통해 Ebp1 뇌 특이적 결손마우스는 소뇌형성부전에 따른 운동성 저하가 나타나는 것을 확인했다.조현병 증상을 확인하기 위해 주로 사용하는 선행자극 억제 실험에서는 야생형에 비해 그 수치가 87% 감소한 상태로 조현병 유사 행동을 보였다.또한 Ebp1 결핍에 따른 소뇌위축의 기작을 찾기 위해 RNA-seq, ChIP-seq을 수행한 결과 Ebp1이 FBXW7(E3 연결 효소, E3 ligase) 히스톤 아세틸화(Histone acetylation)를 억제함으로써 퍼킨지 세포 발달에 중요한 전사인자인 PTF1A 단백질의 안정성을 향상시키는 것으로 나타났다.이에 소뇌발달의 복구 및 조현병 증상의 완화를 확인하기 위해 임신한 Ebp1 결손마우스의 배아 소뇌에 자궁 내 전기천공법을 이용해 Ebp1 야생형과 돌연변이형을 각각 다시 발현시킨 후 태어나게 했다.이후 소뇌발달과 조현병 증상을 확인했는데, Ebp1 야생형이 주입된 마우스는 정상적인 소뇌발달이 이뤄지고 조현병 증상이 완화된 반면, 돌연변이를 주입한 마우스는 여전히 발달이상이 생기고 조현병 증상이 전혀 호전되지 않았다. 이는 Ebp1의 돌연변이가 조현병 및 소뇌의 기능 장애에 중요한 연관이 있다는 사실을 규명한 것이라고 할 수 있다.따라서 이번 연구는 유전적 소인이 주된 발병 원인인 조현병에서 Ebp1이라는 새로운 유전적 요인을 발견하고, 대뇌 중심의 연구에서 벗어나 소뇌기능과 발달성 정신질환의 상관성을 제시했다는 점에서 의미가 크다.“소뇌발생부전의 원인 기전으로 작용하는 후성유전학적 변이와 이를 제어하는 분자적 기전을 규명함으로써 향후 분자수준에서 소뇌발생 제어 및 소뇌손상 극복 기술 개발을 가능하게 하는 중개 융합연구로 발전하길 기대합니다. 무엇보다 이번 연구는 조현병 환자 맞춤형 치료의 토대를 마련한 연구라고 자부합니다.즉, 운동성 저하를 보이는 조현병 환자를 대상으로 MRI를 시행해 소뇌위축을 확인하고 유전자 검사로 Ebp1 돌연변이를 확인해 유전자편집기술로 교정하는 등의 치료전략을 세울 수 있는 것이죠. 향후 실용화 및 치료제 적용을 위해서는 실제 임상적 치료 전략을 개선할 수 있는지에 대한 후속연구 진행이 필요합니다.”이번 연구성과는 국제학술지 ‘분자정신의학 (Molecular Psychiatry)’ 2022년 2월 15일 자 온라인 게재 및 표지에 선정되었다. 현재 관련 내용으로 특허가 진행 중에 있으며, 조현병 치료제 개발의 중요한 단초가 될 것으로 기대된다.
조현병의 새로운 유전적 요인 발견연구팀은 조현병 환자의 사후뇌조직 엑솜 시퀀싱(SCHEMA:Schizophrenia exome meta-analysis condortium)으로부터 Ebp1 돌연변이가 발견됨에 따라 Ebp1 뇌 특이적 결손마우스를 제작했다.여러 가지 동물행동실험을 통해 Ebp1 뇌 특이적 결손마우스는 소뇌형성부전에 따른 운동성 저하가 나타나는 것을 확인했다.조현병 증상을 확인하기 위해 주로 사용하는 선행자극 억제 실험에서는 야생형에 비해 그 수치가 87% 감소한 상태로 조현병 유사 행동을 보였다.또한 Ebp1 결핍에 따른 소뇌위축의 기작을 찾기 위해 RNA-seq, ChIP-seq을 수행한 결과 Ebp1이 FBXW7(E3 연결 효소, E3 ligase) 히스톤 아세틸화(Histone acetylation)를 억제함으로써 퍼킨지 세포 발달에 중요한 전사인자인 PTF1A 단백질의 안정성을 향상시키는 것으로 나타났다.이에 소뇌발달의 복구 및 조현병 증상의 완화를 확인하기 위해 임신한 Ebp1 결손마우스의 배아 소뇌에 자궁 내 전기천공법을 이용해 Ebp1 야생형과 돌연변이형을 각각 다시 발현시킨 후 태어나게 했다.이후 소뇌발달과 조현병 증상을 확인했는데, Ebp1 야생형이 주입된 마우스는 정상적인 소뇌발달이 이뤄지고 조현병 증상이 완화된 반면, 돌연변이를 주입한 마우스는 여전히 발달이상이 생기고 조현병 증상이 전혀 호전되지 않았다. 이는 Ebp1의 돌연변이가 조현병 및 소뇌의 기능 장애에 중요한 연관이 있다는 사실을 규명한 것이라고 할 수 있다.따라서 이번 연구는 유전적 소인이 주된 발병 원인인 조현병에서 Ebp1이라는 새로운 유전적 요인을 발견하고, 대뇌 중심의 연구에서 벗어나 소뇌기능과 발달성 정신질환의 상관성을 제시했다는 점에서 의미가 크다.“소뇌발생부전의 원인 기전으로 작용하는 후성유전학적 변이와 이를 제어하는 분자적 기전을 규명함으로써 향후 분자수준에서 소뇌발생 제어 및 소뇌손상 극복 기술 개발을 가능하게 하는 중개 융합연구로 발전하길 기대합니다. 무엇보다 이번 연구는 조현병 환자 맞춤형 치료의 토대를 마련한 연구라고 자부합니다.즉, 운동성 저하를 보이는 조현병 환자를 대상으로 MRI를 시행해 소뇌위축을 확인하고 유전자 검사로 Ebp1 돌연변이를 확인해 유전자편집기술로 교정하는 등의 치료전략을 세울 수 있는 것이죠. 향후 실용화 및 치료제 적용을 위해서는 실제 임상적 치료 전략을 개선할 수 있는지에 대한 후속연구 진행이 필요합니다.”이번 연구성과는 국제학술지 ‘분자정신의학 (Molecular Psychiatry)’ 2022년 2월 15일 자 온라인 게재 및 표지에 선정되었다. 현재 관련 내용으로 특허가 진행 중에 있으며, 조현병 치료제 개발의 중요한 단초가 될 것으로 기대된다. 뇌질환의 근원에 다가서다 ‘신경생화학연구실’안 교수가 이끄는 ‘신경생화학연구실’에서 수행 중인 연구는 크게 세 분야 정도로 나뉜다. 첫 번째로는 신경세포가 ‘어떻게’, ‘왜’ 죽는가이다.“신경세포의 사멸은 배아 발생 동안 뇌가 정상적인 형태를 갖추기 위해 비정상적이거나 불필요한 세포를 Apoptosis라는 자멸사 과정를 통해 제거하는 중요한 일입니다.하지만 발생이 다 끝난 후, 성체의 뇌에서 신경세포의 죽음은 사실 ‘재앙’이라고 할 수 있죠. 따라서 이 과정의 실패, 즉 신경세포의 비정상적 사멸은 여러 퇴행성 신경질환의 병인이기도 합니다. 저희는 이런 신경세포의 사멸과 생존에 있어 중요한 단백질들을 발굴하고 그 기전을 연구하고 있습니다.”두 번째로는 퇴행성 신경질환과 외상성 손상 같은 여러 요인에 의해 생기는 중추신경계 축삭 손상에 대한 연구를 수행하고 있다. 중추신경계 뉴런 축삭 손상은 아주 제한적이고, 거의 재생이 불가능하다고 알려져 있다. 중추신경계의 척박한 환경이 가장 큰 이유로 지목되었지만, 신경세포 외부의 억제신호들을 제어해도 여전히 신경재생이 기대만큼 되지 않는다는 사실이 보고되면서 과학자들은 성체신경세포의 매우 낮은 재생능력을 또 다른 큰 이유로 보고 있다.연구실에서는 중추신경계 축삭 손상 후 일어나는 변화와 재생이 어려운 원인을 분자적으로 이해하고 손상된 신경의 재생을 촉진하는 방법을 찾고 있다.세 번째는 신경발달장애와 퇴행성 뇌질환의 원인 및 기전 연구로, 최근 연구실에서 가장 집중하는 분야다.정상적인 신경발달 조절 기전을 이해하고 그 과정에서 일어나는 전사 조절, 후성유전학적 조절, 유비퀴틴 매개 단백질 분해 기전과 같은 단백질 번역 후 수식 기전의 조절 등이 신경발생 동안 비정상적으로 작동하면 이번 연구처럼 조현병 등 신경정신질환의 원인이 될 수도 있다.또한 노화 과정 동안 일어나게 되는 이러한 기작들의 오작동이 결국 뉴런의 죽음과 그로 인한 시냅스 붕괴를 일으키고, 이것이 알츠하이머성 치매와 같은 퇴행성 뇌질환의 원인이 되기도 한다. 따라서 연구실에서는 이러한 전사·후성유전학적 조절과 단백질 번역 후 수식 기전의 오류를 찾아 교정하는 방안을 모색하고 있다.“연구실이 의과대학에 소속되어 있어 여러 장점이 있습니다. 물론 우수한 연구시설과 장비를 보유하고 있다는 물리적인 장점도 있지만, 특히 인간의 질병에 대한 연구를 하는 데에 있어 임상적 의의와 적용 방안을 항상 생각하게 하고 조언을 아끼지 않는 동료교수님들이 계신다는 점입니다.그리고 해당 질병의 환자를 직접 보고, 연구를 하는 임상연구자분들과 협동연구를 비교적 쉽게 진행할 수도 있죠. 또 다른 측면에서 의과대학 대학원이다 보니 학부나 전공이 다른 다양한 배경의 대학원생들이 같이 모여 연구를 수행하기 때문에 비교적 수평적인 의사소통이 가능하다는 점도 강점이라고 할 수 있습니다.”
뇌질환의 근원에 다가서다 ‘신경생화학연구실’안 교수가 이끄는 ‘신경생화학연구실’에서 수행 중인 연구는 크게 세 분야 정도로 나뉜다. 첫 번째로는 신경세포가 ‘어떻게’, ‘왜’ 죽는가이다.“신경세포의 사멸은 배아 발생 동안 뇌가 정상적인 형태를 갖추기 위해 비정상적이거나 불필요한 세포를 Apoptosis라는 자멸사 과정를 통해 제거하는 중요한 일입니다.하지만 발생이 다 끝난 후, 성체의 뇌에서 신경세포의 죽음은 사실 ‘재앙’이라고 할 수 있죠. 따라서 이 과정의 실패, 즉 신경세포의 비정상적 사멸은 여러 퇴행성 신경질환의 병인이기도 합니다. 저희는 이런 신경세포의 사멸과 생존에 있어 중요한 단백질들을 발굴하고 그 기전을 연구하고 있습니다.”두 번째로는 퇴행성 신경질환과 외상성 손상 같은 여러 요인에 의해 생기는 중추신경계 축삭 손상에 대한 연구를 수행하고 있다. 중추신경계 뉴런 축삭 손상은 아주 제한적이고, 거의 재생이 불가능하다고 알려져 있다. 중추신경계의 척박한 환경이 가장 큰 이유로 지목되었지만, 신경세포 외부의 억제신호들을 제어해도 여전히 신경재생이 기대만큼 되지 않는다는 사실이 보고되면서 과학자들은 성체신경세포의 매우 낮은 재생능력을 또 다른 큰 이유로 보고 있다.연구실에서는 중추신경계 축삭 손상 후 일어나는 변화와 재생이 어려운 원인을 분자적으로 이해하고 손상된 신경의 재생을 촉진하는 방법을 찾고 있다.세 번째는 신경발달장애와 퇴행성 뇌질환의 원인 및 기전 연구로, 최근 연구실에서 가장 집중하는 분야다.정상적인 신경발달 조절 기전을 이해하고 그 과정에서 일어나는 전사 조절, 후성유전학적 조절, 유비퀴틴 매개 단백질 분해 기전과 같은 단백질 번역 후 수식 기전의 조절 등이 신경발생 동안 비정상적으로 작동하면 이번 연구처럼 조현병 등 신경정신질환의 원인이 될 수도 있다.또한 노화 과정 동안 일어나게 되는 이러한 기작들의 오작동이 결국 뉴런의 죽음과 그로 인한 시냅스 붕괴를 일으키고, 이것이 알츠하이머성 치매와 같은 퇴행성 뇌질환의 원인이 되기도 한다. 따라서 연구실에서는 이러한 전사·후성유전학적 조절과 단백질 번역 후 수식 기전의 오류를 찾아 교정하는 방안을 모색하고 있다.“연구실이 의과대학에 소속되어 있어 여러 장점이 있습니다. 물론 우수한 연구시설과 장비를 보유하고 있다는 물리적인 장점도 있지만, 특히 인간의 질병에 대한 연구를 하는 데에 있어 임상적 의의와 적용 방안을 항상 생각하게 하고 조언을 아끼지 않는 동료교수님들이 계신다는 점입니다.그리고 해당 질병의 환자를 직접 보고, 연구를 하는 임상연구자분들과 협동연구를 비교적 쉽게 진행할 수도 있죠. 또 다른 측면에서 의과대학 대학원이다 보니 학부나 전공이 다른 다양한 배경의 대학원생들이 같이 모여 연구를 수행하기 때문에 비교적 수평적인 의사소통이 가능하다는 점도 강점이라고 할 수 있습니다.” 도전은 모든 위대한 일의 시작이다어려움을 이겨내고 얻어낸 성과는 더욱 값지고 소중하다. 그렇기에 연구자들의 연구가 성공을 거두고 그 결과가 세상에 빛을 보게 되는 것은 매우 값진 일이다. 그 한 번의 성공 이면에는 우리가 보지 못했던 아흔아홉 번의 실패가 있었기 때문이다.하지만 그 아흔아홉 번의 실패를 견뎌내는 동안 숱한 좌절과 난관을 마주해야 한다. 안 교수가 추진해 온 연구들이 성공의 결실을 맺을 수 있었던 것은 팀원들이 실패에 굴복하지 않고, 흔들림 없이 앞으로 나아갈 수 있도록 때로는 냉철하게, 때로는 따뜻하게 동기를 심어 주었기에 가능한 일이었다.“연구자의 길을 선택한 것은 오롯이 본인의 몫이었고, 진학을 한 것 자체가 평범한 일은 아닐 것입니다.연구자의 길에 들어선 것은 하루에도 열두 번씩 밀려오는 좌절감과 난관을 내 몫으로 받아들여 겪어내고, 알고 있는 바탕 위에 조금이라도 더 보탤 무언가를 찾아가겠다는 의지를 세상에 공표한 것이죠. 선택을 하기 전에 내가 어떤 사람인지, 내가 무엇을 하고자 하는지, 내가 원하는 것이 무엇이지 잘 생각 보고, 일단 선택을 했다면 철저하게 그 선택을 존중하고 순응해야 한다는 생각입니다.”아울러 안 교수는 연구현장에 있다 보면 결과를 쉽게 내려고만 하거나 도전할 수 없는 일이라 지레짐작해 중도에 포기하는 학생들이 많다며, 당장은 힘이 들더라도 원하던 연구를 해보고, 시작했다면 최선을 다했으면 하는 바람을 전했다.“가장 안타까운 건 큰 산을 하나 넘어보면 그다음에는 다른 산들이 별것 아닌 것처럼 보이기도 하고 더 높은 산 앞에서도 움츠러들지 않을 텐데 산이 크다고 항상 산 밑에서 왔다 갔다 하거나 조금 오르다 마는 친구들을 볼 때입니다. 때로는 무식하게 도전해 보는 것도 필요하다고 생각해요. 쓰러지지 않을 만큼만 하고 멈추는 게 아니라 쓰러질 때까지 한번 몰두해 보면 문득 일이 쌓이고 산 하나를 넘었음을 깨닫게 되죠. 그렇게 산을 한번 넘어보면 보이는 게 달라집니다.경제 법칙은 최소한의 노력으로 최대한의 이윤을 추구하는 게 맞겠지만, 생명과학을 연구하는 과학자로, 연구자로 살기 위해서는 최대한의 노력을 해서 최대 그 너머의 무엇을 추구하라고 감히 말하고 싶습니다.”안 교수는 또 한 가지 바람으로 연구비 중단이나 수주에 대한 걱정 없이 안정적이고 계획적으로, 심도 있게 연구에 몰두하고 싶다고 덧붙였다. 대부분의 기초연구를 수행하는 연구실들은 업-다운 사이클을 반복하게 되는데, 이러한 기복 없이 장기적인 관점에서 깊이 있게 연구를 이끌어 갈 수 있는 환경이 갖춰졌으면 한다는 것이다.아울러 연구 결과를 실제 임상에 적용 가능한 수준으로 끌어올려 의·과학과 산업계, 그리고 인류에 직접 기여할 수 있기를 희망한다고 전했다.거듭되는 도전을 거치며 어느덧 의·과학계의 새로운 길을 여는 주역으로 자리매김 한 안 교수. 매번 상식을 뛰어넘어 온 그를 보며 문득 ‘도전은 모든 위대한 일의 시작이다.’라는 구절이 떠올랐다. 안 교수의 새로운 도전이 질환으로 고통 받고 있는 이들의 ‘위대한 희망’이 되기를 마음 깊이 기대해본다.
도전은 모든 위대한 일의 시작이다어려움을 이겨내고 얻어낸 성과는 더욱 값지고 소중하다. 그렇기에 연구자들의 연구가 성공을 거두고 그 결과가 세상에 빛을 보게 되는 것은 매우 값진 일이다. 그 한 번의 성공 이면에는 우리가 보지 못했던 아흔아홉 번의 실패가 있었기 때문이다.하지만 그 아흔아홉 번의 실패를 견뎌내는 동안 숱한 좌절과 난관을 마주해야 한다. 안 교수가 추진해 온 연구들이 성공의 결실을 맺을 수 있었던 것은 팀원들이 실패에 굴복하지 않고, 흔들림 없이 앞으로 나아갈 수 있도록 때로는 냉철하게, 때로는 따뜻하게 동기를 심어 주었기에 가능한 일이었다.“연구자의 길을 선택한 것은 오롯이 본인의 몫이었고, 진학을 한 것 자체가 평범한 일은 아닐 것입니다.연구자의 길에 들어선 것은 하루에도 열두 번씩 밀려오는 좌절감과 난관을 내 몫으로 받아들여 겪어내고, 알고 있는 바탕 위에 조금이라도 더 보탤 무언가를 찾아가겠다는 의지를 세상에 공표한 것이죠. 선택을 하기 전에 내가 어떤 사람인지, 내가 무엇을 하고자 하는지, 내가 원하는 것이 무엇이지 잘 생각 보고, 일단 선택을 했다면 철저하게 그 선택을 존중하고 순응해야 한다는 생각입니다.”아울러 안 교수는 연구현장에 있다 보면 결과를 쉽게 내려고만 하거나 도전할 수 없는 일이라 지레짐작해 중도에 포기하는 학생들이 많다며, 당장은 힘이 들더라도 원하던 연구를 해보고, 시작했다면 최선을 다했으면 하는 바람을 전했다.“가장 안타까운 건 큰 산을 하나 넘어보면 그다음에는 다른 산들이 별것 아닌 것처럼 보이기도 하고 더 높은 산 앞에서도 움츠러들지 않을 텐데 산이 크다고 항상 산 밑에서 왔다 갔다 하거나 조금 오르다 마는 친구들을 볼 때입니다. 때로는 무식하게 도전해 보는 것도 필요하다고 생각해요. 쓰러지지 않을 만큼만 하고 멈추는 게 아니라 쓰러질 때까지 한번 몰두해 보면 문득 일이 쌓이고 산 하나를 넘었음을 깨닫게 되죠. 그렇게 산을 한번 넘어보면 보이는 게 달라집니다.경제 법칙은 최소한의 노력으로 최대한의 이윤을 추구하는 게 맞겠지만, 생명과학을 연구하는 과학자로, 연구자로 살기 위해서는 최대한의 노력을 해서 최대 그 너머의 무엇을 추구하라고 감히 말하고 싶습니다.”안 교수는 또 한 가지 바람으로 연구비 중단이나 수주에 대한 걱정 없이 안정적이고 계획적으로, 심도 있게 연구에 몰두하고 싶다고 덧붙였다. 대부분의 기초연구를 수행하는 연구실들은 업-다운 사이클을 반복하게 되는데, 이러한 기복 없이 장기적인 관점에서 깊이 있게 연구를 이끌어 갈 수 있는 환경이 갖춰졌으면 한다는 것이다.아울러 연구 결과를 실제 임상에 적용 가능한 수준으로 끌어올려 의·과학과 산업계, 그리고 인류에 직접 기여할 수 있기를 희망한다고 전했다.거듭되는 도전을 거치며 어느덧 의·과학계의 새로운 길을 여는 주역으로 자리매김 한 안 교수. 매번 상식을 뛰어넘어 온 그를 보며 문득 ‘도전은 모든 위대한 일의 시작이다.’라는 구절이 떠올랐다. 안 교수의 새로운 도전이 질환으로 고통 받고 있는 이들의 ‘위대한 희망’이 되기를 마음 깊이 기대해본다. 취재기자 / 안유정(reporter1@s21.co.kr)<이 기사는 사이언스21 매거진 2022년 6월호에 게재 되었습니다.>글쓴날 : [22-06-03 15:01]
취재기자 / 안유정(reporter1@s21.co.kr)<이 기사는 사이언스21 매거진 2022년 6월호에 게재 되었습니다.>글쓴날 : [22-06-03 15:01]